在哺乳动物中,原始卵泡被认为是有限的资源,任何因素干扰原始卵泡的组装都可能影响可利用的卵母细胞数,并增加卵巢早衰等疾病的风险。因此,可用的原始卵泡数量是决定生殖周期的关键因素,也是家畜繁殖和种质资源保护的前提。值得注意的是,储存在原始卵泡中的卵母细胞,称为不完全生长的卵母细胞(non-growing oocytes, NGO),而只有有限数量的卵母细胞被激活和发育,称为完全生长的卵母细胞(fully grown oocytes, FGO)。随着卵母细胞的生长,在成为FGO之前需在细胞质中积累母源mRNA。通常母源mRNA储存在由蛋白质和RNA自发相分离形成的无膜隔室中,例如P-body-like granules和线粒体相关的核糖核蛋白结构域(mitochondria-associated ribonucleoprotein domain, MARDO)。已有研究表明在FGO中储存母源mRNA的无膜隔室为MARDO并剖析其成员为ZAR1, LSM14B, DDX6, YBX2, 4E-T[1];另外,在NGO中存在着P-body-like granules,这些颗粒作为储存原始卵泡相关基因的无膜隔室[2]。但是,关于在NGO中储存母源mRNA的机制仍然存在很多未知。
近日,tyc1286太阳成集团肉羊团队以Article形式在Cellular and Molecular Life Sciences(发表当年IF=9.2)上发表了题为“LSM14B controls oocyte mRNA storage and stability to ensure female fertility”的研究成果。该团队深入探究了在NGO中LSM14B对原始卵泡组装和母源mRNA储存的作用以及在FGO中决定卵母细胞质量的机制。

LSM14B是生殖细胞中P-body-like granules和MARDO无膜区室的共有蛋白之一。为进一步探究LSM14B对无膜隔室、原始卵泡库组装的作用,该团队利用10X单细胞测序、免疫沉淀、蛋白质谱测序的方法分析LSM14B-KO模型,发现LSM14B的敲除不仅会破坏原始卵泡组装还会影响mRNA的稳定性,同时伴随着P-body-like granules的组装受损。
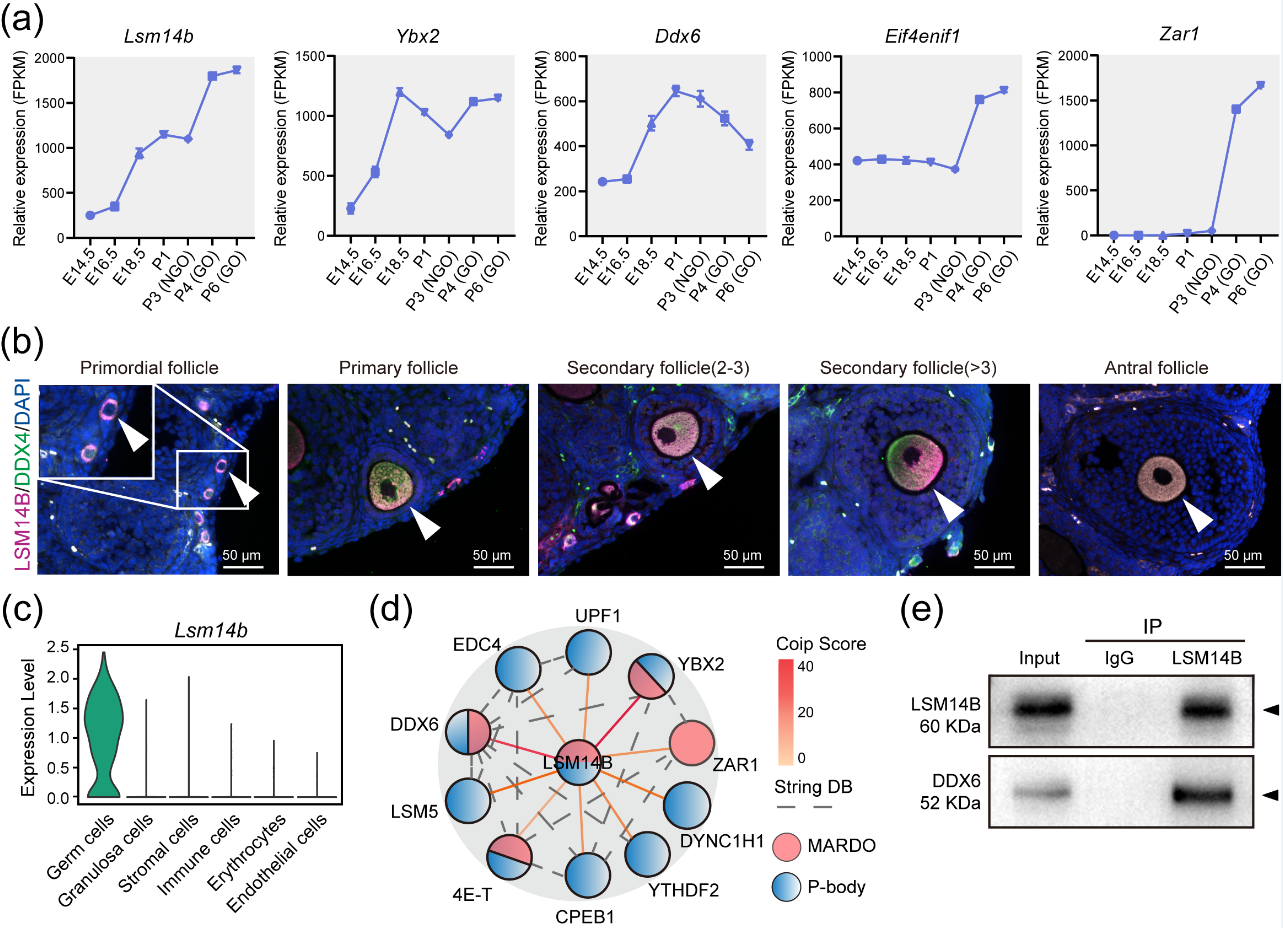
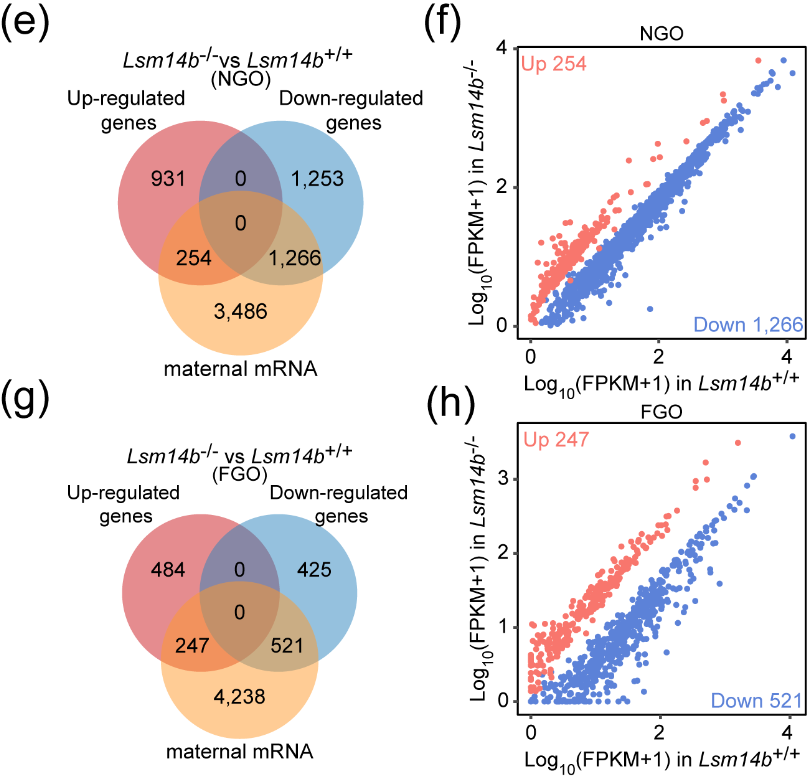
LSM14B作为RNA结合蛋白,它的缺失会影响mRNA的稳定性。因此,该研究团队探究了LSM14B对NGO和FGO中储存母源mRNA稳定性的影响。结果表明LSM14B的缺失不仅会影响母源mRNA的积累而且伴随着MARDO核心蛋白的降解,值得注意的是对NGO产生的影响显著大于FGO。
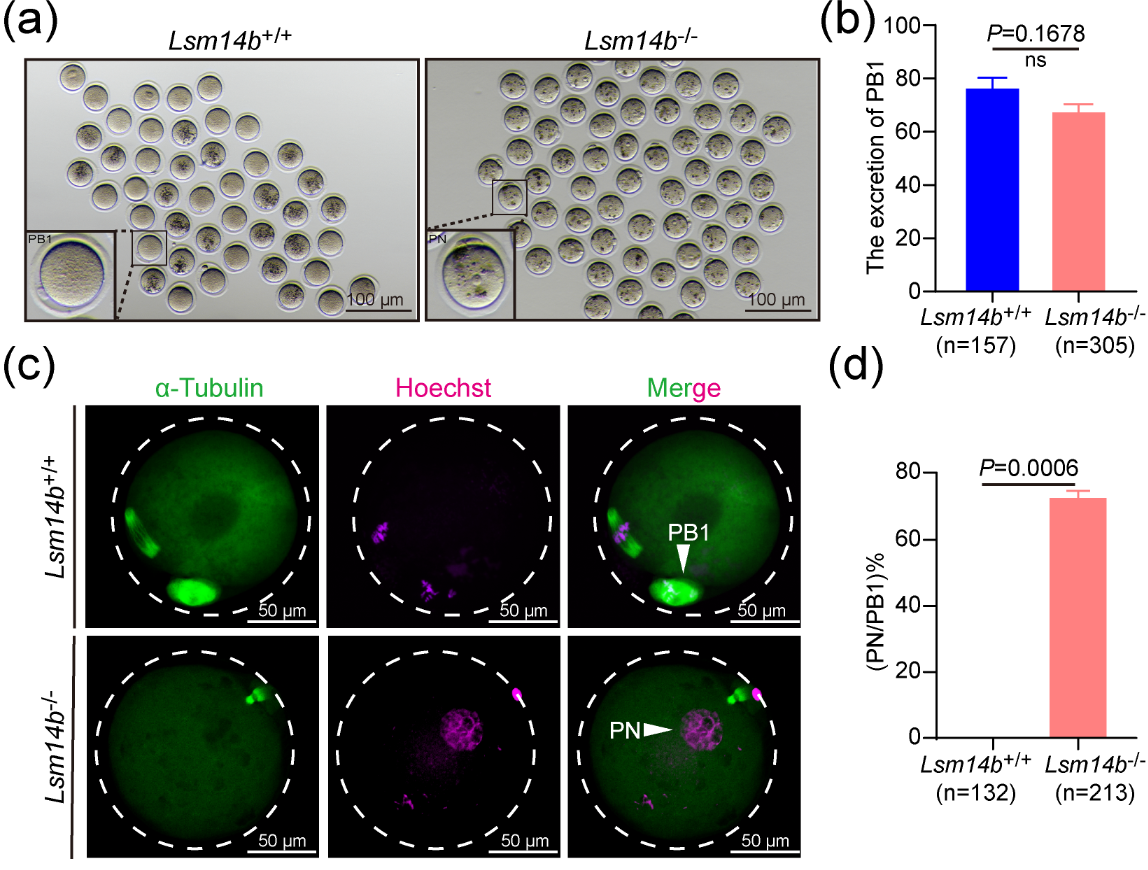
最后,敲除LSM14B的卵母细胞在排出第一极体后无法进入第二次减数分裂中期并重组了含有脱聚染色质的原核。该研究团队检测了成熟促进因子(maturation promoter factor, MPF)的活性,发现敲除LSM14B会破坏MPF的活性,同时利用WEE1/2抑制剂可挽救表型缺陷。
该研究通过多组学技术联合分析,揭示了LSM14B在卵子发生方面的功能,解析了LSM14B对原始卵泡库的建立以及在卵母细胞中储存母源mRNA无膜隔室的作用,为探究母源mRNA的储存和稳定提供了新的思路。该工作得到了内蒙古自治区种业科技创新重大示范工程“揭榜挂帅”项目(2022JBGS0024)、国家自然科学基金(32260180; 32260181; 32000582)、内蒙古自治区青年科技英才项目(NJYT23013)、中央引导地方科技发展基金(2022ZY0188)、内蒙古自治区重大专项子课题(2019ZD031; 2021ZD0048)的资助。44118太阳成城集团的刘永斌研究员、周扬教授和张滕教授为本论文的共同通讯作者。2021级博士生单丽莹、2021级博士生田宇、2020级博士生刘文祥为本论文的共同第一作者。
主要参考文献:
1. Cheng S, Altmeppen G, So C, Welp LM, Penir S, Ruhwedel T, et al. Mammalian oocytes store mRNAs in a mitochondria-associated membraneless compartment. Science. 2022; 378 (6617): eabq4835. Epub 2022/ 10/ 21. doi: 10. 1126/ science. abq4835. PubMed PMID: 36264786.
2. Kato Y, Iwamori T, Ninomiya Y, Kohda T, Miyashita J, Sato M, et al. ELAVL2- directed RNA regulatory network drives the formation of quiescent primordial follicles. EMBO Rep. 2019; 20 (12): e48251. Epub 2019/ 10/ 28. doi: 10.15252/ embr.201948251. PubMed PMID: 31657143; PubMed Central PMCID: PMCPMC6893360.


![]() 蒙ICP16002391号-1
蒙ICP16002391号-1